 |
|
Polska Fundacja Osteoporozyul. Waryńskiego 6/1, 15-461 Białystok
|
Wersja polska English Version |
Streszczenie
Jednostki „T-score – 2.5” jako kryterium diagnostyczne osteoporozy generowane przez aparaty operujące różnymi technikami i mierzącymi różne miejsca szkieletu są nieporównywalne. Nie umożliwiają zbliżonej oceny rozpowszechnienia osteoporozy ani oceny ryzyka złamań u osób w tym samym wieku i przy tym samym wyniku T-score – 2.5 pochodzących z odmiennych, j.w., pomiarów. Badania epidemiologiczne wykazały występowanie złamań po małym urazie we wszystkich przedziałach masy kostnej. Uznano wobec tego, że próg densytometryczny „osteoporozy” jest inny niż próg diagnostyki złamań i interwencji leczniczej. Masa kostna jest jedną z kilku niezależnych od siebie przyczyn złamań i powinna być brana pod uwagę w przewidywaniu zagrożenia złamaniami na równi z wpływem wieku, obciążeniem dziedzicznym, przebytym złamaniem, niską masą ciała i inwalidztwem ruchowym, zwiększającym podatność na upadki. Uzasadnia to potrzebę diagnozowania i zapobiegania/leczenia zagrożenia złamaniami, a nie tylko wypełnianie kryterium densytometrycznego „osteoporozy”. Leczenie obejmuje eliminację osobniczych czynników ryzyka złamań, suplementację wapnia i witaminy D, wzmożenie usprawniającej aktywności fizycznej oraz leczenia lekami antyresorpcyjnymi, które wykazały skuteczność w zapobieganiu złamań: Działające drogą receptorową - estrogeny i HTZ do 60 r.ż., raloksyfen 60 mg/dz., kalcytoninę 200 IU/dz. donosowo, lub 100 IU parenteralnie, oraz działających pozareceptorowo – risedronian 5 mg/dz., alendronian 10 mg/dz. i etydronian 400 mg 4 x w roku. Optymalnym jest indywidualne dostosowanymi leku do problemu zdrowotnego pacjenta, i z wykorzystaniem jego również pozaszkieletowych, a przydatnych w leczeniu jednocześnie z osteoporozą występujących zagrożeń zdrowotnych pacjenta.
Jak osteoporoza wymknęła się spod kontroli?
Adresatami tego zbioru informacji są ci, którzy w swoich gabinetach na co dzień zaangażowani są w diagnostykę i leczenie osteoporozy, których reputacja i sukces zawodowy zależy od trafności rozpoznania zagrożenia złamaniem i od skuteczności jego zapobieżenia. Jest osobisty, emocjonalny, gdyż sam uczestniczyłem w popularyzacji wiedzy, którą niniejszym artykułem weryfikuję.
Naturalny rozwój wiedzy na temat osteoporozy (OP) uzupełniał jej kolejne definicje o elementy wynikłe z aktualnych badań nad metabolizmem, wytrzymałością i masą kości oraz z analiz epidemiologicznych. Od czasu: „za mało kości w kości” Albrighta (1), kolejne sformułowania uwzględniały relacje pomiędzy masą kości a wiekiem, płcią i rasą oraz wynikającą stąd podatnością na złamania. Definicja WHO (21) z 1994 roku, nakazuje widzieć w osteoporozie „chorobę układową szkieletu charakteryzującą się niską masą kości, zaburzoną mikrostrukturą kości zwiększającą podatność na złamania”. W myśl niej OP dotyczy całego kośćca, a jego wytrzymałość mechaniczną warunkują masa (cecha ilościowa) i mikrobudowa (cecha jakościowa), czyli im niższa masa i gorsze utkanie kości - tym większa szansa na złamanie. Ta niepodważalna logika wymagała jeszcze uściślenia, jaka masa kości jest prawidłowa, a jaka nie jest już w stanie podołać rutynowym obciążeniom szkieletu i zagraża złamaniem pod wpływem banalnego urazu.
Grupa Robocza WHO zaproponowała cztery przedziały diagnostyczne masy kości (skrótowo i umownie, = BMD – bone mineral density = gęstość mineralna kości) pomiędzy zdrowiem a zaawansowaną osteoporozą. Posłużono się wskaźnikiem „T-score” odpowiadającemu odchyleniu standardowemu od szczytowej masy kostnej młodych, zdrowych kobiet rasy kaukaskiej osiągniętej w 20 -29 roku życia, oraz wskaźnikiem „Z-score” porównującego jednostkowy wynik z średnią BMD kobiet w tym samym wieku jak badana osoba.
Za prawidłowe uważa się wyniki BMD pomiędzy T-score minus 1.0 a plus 1.0, za „osteoporozę” poniżej minus 2.5 (jako że z analiz statystycznych badań epidemiologicznych znanych w tym czasie wynikało, że 95% osób ze złamaniami cechowało się masą kostną o T-score poniżej minus 2.5), przestrzeń pomiędzy zdrowiem a osteoporozą wypełnia niska masa kości, czyli „osteopenia”, zaś osteoporoza z obecnością złamań nosi nazwę zaawansowanej.
Miejscem pomiaru BMD przy ustalaniu w/w kategorii była szyjka kości udowej, (sz.k.u.) a DEXA – jej metodą.
W owym czasie było to wielkim osiągnięciem. Uporządkowano bowiem dowolnie stosowane dotąd kryteria diagnostyczne. Praktyka jednakże szybko zdeformowała nową formułę diagnostyczną. Szybkie rozprzestrzenienie się i atrakcyjność tej formuły wynikała z jej prostoty: Aparat + wynik T-score minus 2.5 = Leczenie „osteoporozy”. Przypadki powyżej T-score minus 2.5 nie zasłużyły na uwagę. Produkowano i stosowano do diagnostyki, a za tym idzie decyzja o leczeniu, aparaty operujące odmiennymi niż DEXA metodami, pomiary prowadzono zarówno w biodrze, jak i w kręgosłupie, na przedramieniu, na pięcie, palcu, kości piszczelowej, rzepce. Bez względu na miejsce pomiaru i metodę stosowano identyczne kryteria diagnostyczne oparte na „T-score”. „Osteoporozę” utożsamiono w wydrukiem badania na jakimkolwiek aparacie, aby tylko na nim widniał „T-score minus 2.5”. Co gorsze, wiele państwowych i prywatnych ubezpieczalni na świecie refundowało tylko leczenie poparte wynikiem T-score –2.5.
To powszechne stosowanie wskaźnika „T-score” jako wskazówki diagnostycznej, podbudowanej autorytetem WHO, szybko przyniosło nowe doświadczenia, a wraz z nimi - nowe pytania. Jeśli w jednym miejscu szkieletu wykryjemy T-score -2.5 a w pozostałych miejscach nie, to jest to osteoporoza czy nie? – Eksperci odpowiedzieli: osteoporoza dotyczy miejsca, w którym się ją wykryje. I powstał już pierwszy konflikt z definicją osteoporozy jako choroby układowej, odnoszącej się do całego szkieletu. Jeżeli złamania po banalnym urazie doznała osoba o BMD np. T-score - 0.9, to czy było to złamanie w przebiegu osteoporozy? – Nie, bo wg definicji można ją rozpoznać dopiero od T-score -2.5. W szóstej dekadzie życia panie doznają złamań Collesa i kręgów, a masa kostna daleka jest od T-score -2.5. To w przebiegu jakiej choroby osoby te, z prawidłową BMD, doznały złamań nadgarstka?
Również wyniki badań epidemiologicznych ostatniego dziesięciolecia odnoszące się do relacji pomiędzy masą kostną z złamaniami zaskoczyły nawet autorów definicji WHO, którzy przyznali, że „próg diagnostyczny osteoporozy jest inny niż próg diagnostyki zagrożenia złamaniem i interwencji leczniczej” (12,13,14). Konsensus Narodowych Instytutów Zdrowia (NIH) i Narodowej Fundacji Osteoporozy (NOF) USA (18) wręcz zmienił definicję osteoporozy, mówiąc, że „jest chorobą szkieletu cechującego się zmniejszoną wytrzymałością kości* (*wynikającej z gęstości mineralnej i jakości funkcjonalnej), i zwiększającą ryzyko złamania”. Nie uzależnia już rozpoznania osteoporozy ani ryzyka złamań od jakichkolwiek zakresów BMD. Dlaczego? - Czy powstał kolejny konflikt pomiędzy definicją osteoporozy, a raczej jej kryteriami densytometrycznymi, a jej istotą, tzn. złamaniami? - Czemu powinniśmy dać pierwszeństwo w naszej codziennej praktyce? – Czyli: co diagnozować oraz co i kogo leczyć? – mając stale na uwadze, że leczymy indywidualnego pacjenta, a nie populację, leczymy pacjenta a nie tylko osteoporozę i nie BMD, a więc indywidualizacja - zarówno diagnostyki jak i leczenia dopasowanego do problemu zdrowotnego pacjenta – jest wymogiem niezbywalnym.
Logika dochodzenia do odpowiedzi na tak postawione pytania.
Najwięcej rozczarowania lekarzom dostarczyło stosowanie różnych technik i badań w różnych miejscach szkieletu przy stosowaniu identycznych zakresów diagnostycznych WHO. Przed wynikami badań densytometrycznych stawia się przynajmniej dwa podstawowe wymogi: 1. Czy odmienne techniki pomiarów są w stanie podobnie ocenić rozpowszechnienie OP w populacji, np. ile kobiet w wieku 70 lat dotkniętych jest chorobą? – i 2. Czy są w stanie podobnie ocenić ryzyko złamania u osób z tą samą masą kostną i w tym samym wieku, np. jakie jest ryzyko, np. 5-letnie, złamania u kobiet w wieku 70 lat z T-score – 2.5?
D. Black z wsp.(3) zdając sprawę w imieniu NOF, ISCD (Międzynarodowego Towarzystwa Densytometrii Klinicznej) i ASBMR (Amerykańskiego Towarzystwa Badawczego Kości i Minerałów posłużył się meta-analizami. I tak: odsetek kobiet 70-letnich wypełniających kryterium WHO OP (T-score –2.5), w zależności w jakim miejscu i jakimi technikami badano, różni się zasadniczo. W biodrze – od 12% do 24%, w kręgosłupie – od 12% do 35%, na przedramieniu – 25%, w pięcie – od 4% do 20%, na palcu – 55%. Badając zatem tę samą populację jednym aparatem, wykrywa on OP u co 2 osoby w wieku 70 lat, innym zaś u co 25 osoby. Skrajne różnice są rzędu 1450% (!). Jeśli w ślad za takimi rozpoznaniami wszczynano leczenie antyresorpcyjne, to w jednych gabinetach, z takimi parametrami, leczono 4% pacjentek, w innych – 55%.
Podobnie ma się ocena 5-letniego ryzyka złamania sz.k.u. u w/w kobiet. Jeśli przeprowadza się pomiar w biodrze, różne aparaty oceniają to ryzyko na 5 do 7%, badane w kręgosłupie – na 2.9 do 3.5%, na przedramieniu – na 3%, w pięcie – od 3.7 do 6%, na palcu zaś – na 2%. Różnice ocen sięgają 350% (!).
Ponadto, o ile wszystkimi technikami i we wszystkich miejscach pomiaru – z wyjątkiem kręgosłupa – odsetek osób z T-score –2.5 wzrasta logicznie z wiekiem, o tyle w 7 -8 dekadzie życia BMD kręgosłupa wykazuje zaskakująco tendencję zwyżkową (!), co potwierdziły również nasze badania przeprowadzone u 1522 kobiet w latach 1995-1997. Po 12% spadku BMD w VII dekadzie życia, w VIII – wzrosło o 7% (Ryc 1):
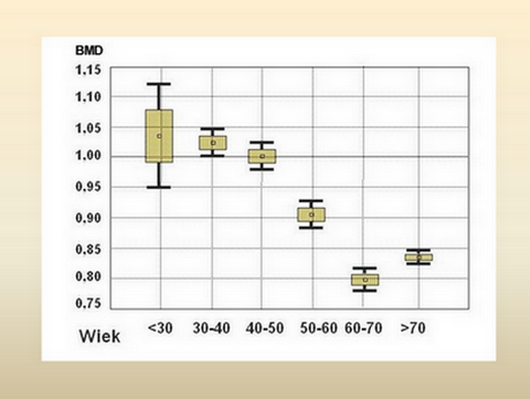
Ryc.1. Zależność BMD kręgosłupa lędźwiowego od wieku.
Na ten trend wpływają narastające zmiany zwyrodnieniowe w kręgosłupie lędźwiowym, co badanie BMD regionu L2-L4 w tym wieku czyni mniej wiarygodnym. Badania BOS (19) przeprowadzone wśród mieszkanek Podlasia również odniosły się do częstości występowania osteoporozy u kobiet powyżej 45 roku życia, wskazując, jak wielkie różnice ocen wynikają z miejsca pomiaru. Jeśli pomiary dotyczyły kręgów lędźwiowych L1-L4, to normę reprezentowało 43.4%, osteopenię – 38,6%, a osteoporozę – 18.4%. Jeśli badano BMD sz.k.u. („Hip Neck”), wyników prawidłowych odnotowano 42.2%, osteopenię – w 43.0% a osteoporozę – w 14.8%. Badanie całkowitej BMD b.n.k.u. („Hip Total”) ujawniło 77.0% osób z prawidłową masą kości, 20.6% z osteopenią i tylko 2.4% z osteoporozą. Wobec takich rozbieżności, zrozumiałą jest rygorystyczna rekomendacja IOF z 2000 r. (12): ”aby zastosowanie diagnostyczne T-score było zarezerwowane jedynie do pomiarów BMD szyjki kości udowej metodą DEXA”. Czy wobec tego odmienne od DEXA techniki i inne lokalizacje badań są bezużyteczne? - Nie. Ale... Dobrze udokumentowane badania były w stanie odnieść się do relacji pomiędzy pomiarami BMD w różnych miejscach szkieletu a ryzykiem złamania w miejscu badania i w szyjce kości udowej, i odwrotnie – jak pomiar BMD w sz.k.u. przewiduje złamania w innych miejscach kośćca. Meta-analiza przeprowadzona przez Marshalla i wsp.(16) (Tabela 1) wskazuje o ile rośnie ryzyko względne (ang. RR = Relativ Risk = ryzyko względne, RW) złamania w miarę spadku BMD o każde 1.0 odchylenie standardowe (SD) poniżej średniej wieku (Z-score):
| Miejsce pomiaru | Złamanie przedramienia | Złamanie sz.k.u. | Złamania kręgu | Złamania wszystkie |
|---|---|---|---|---|
| Przedramię (część dystalna) |
1,7 | 1,8 | 1,7 | 1,4 |
| Bliższa nasada kości udowej (b.n.k.u.) |
1,4 | 2,6 | 1,8 | 1,6 |
| Kręgosłup lędźwiowy |
1,5 | 1,6 | 2,3 | 1,0 |
Najprecyzyjniej ryzyko złamania w określonym miejscu przewiduje badanie tam przeprowadzone. Gdziekolwiek przeprowadzone – podobnie przewiduje „wszystkie złamania”. Przeprowadzone w sz.k.u. - w akceptowalnym stopniu przewiduje złamania w kręgosłupie i przedramieniu. Badanie BMD nie musi odnosić się więc do densytometrycznych zakresów diagnostycznych osteoporozy wg WHO aby ocenić ryzyko złamania, a o to chodzi. Nie inaczej jest z badaniem ultradźwiękowym (QUS). Nie można i nie należy rozpoznawać „osteoporozy” czy „osteopenii” w myśl kryteriów WHO posługując się w nim jednostkami „T-score”, ale można określić nim zagrożenie złamania bliższej nasady kości udowej (b.n.k.u.). I tak, każdy spadek o 1.0 SD w BUA oznacza wzrost RW złamania b.n.k.u. o 1.7, a każdy spadek o 1.0 SD w SOS – o 1.4, chociaż McGrother (17) - ze spadkiem o 1.0 SD dB/MHz w BUA i wzrostem RW 1.1 - nie był w stanie wykazać niezależności tego badania w przewidywaniu złamań b.n.k.u.
Wadą wyrażania wyników pomiarów BMD w jednostkach ryzyka względnego, tzn. takiego, który cyfrowo wyraża: o ile osoby o danym BMD mają zwiększone ryzyko złamania w porównaniu do populacji ogólnej, jest brak informacji o takim ryzyku w Polsce. Np. RW = 1.4 oznacza, że badana cecha jest większa o 0.4 od 1.0, a 1.0 wyraża ryzyko populacyjne. RW = 2.0 oznacza dwukrotne jego zwiększenie, tzn o 100%, a więc RW = 1.4 mówi o 40% wzroście np. zagrożenia złamaniem w porównaniu do ryzyka populacyjnego. Ale jakie ono jest? – Taką bazą danych dysponuje tylko Szwecja. Zrozumiałym jest więc konsensus wszystkich gremiów międzynarodowych, że najwłaściwszym sposobem jest określanie indywidualnego, bezwzględnego ryzyka (ang. AR = Absolute Risk = ryzyko bezwzględne, RB) złamania u badanej osoby w perspektywie najbliższych 10 lat. I znów: nie leczymy populacji tylko tą jedyną osobę, którą mamy w gabinecie przed sobą.
T-score sobie, a złamania sobie...
Black z zesp.(3), powołując się na modelowe badanie NHANES III (15 ) zwrócił uwagę na wpływ samego wieku na 5-letnie ryzyko złamania b.n.k.u., gdzie przy tym samym BMD o T-score –2.5 w sz.k.u., w wieku 65-69 lat wynosi ono 3.2%, w wieku 70-74 lat - 4.9%, w wieku 75-79 – 8.1%, pięć lat później – już 14.1%, a po 85 roku życia – 23.3%.
Masa kostna (BMD) rozkłada się w populacji zdrowych kobiet w 3 i 4 dekadzie życia w postaci typowej krzywej Gaussa, gdzie prawidłowy zakres T-score od +1.0 do –1.0 obejmuje 70% pań, po 15% zakresy od +1.0 do +2.5 i od –1.0 do –2.5, ale 0.6% zdrowych kobiet wykazuje po jednej stronie krzywej wynik powyżej +2.5, a po drugiej – poniżej –2.5, a więc „osteoporozę”. Odsetek kobiet z OP (T-score – 2.5 wg WHO) rośnie z wiekiem, od kilku procent po 50 r.ż. do 50% po 80 r.ż.(21).
Każde „minus 1.0 T-score” oznacza u badanej osoby dwukrotny wzrost ryzyka złamania. Ale wyłącznie u tej osoby! – bo u innej, nawet przy prawidłowym BMD, złamanie może wynikać z niezależnych od BMD przyczyn. Formuła zwolenników wyłącznego uzależniania złamań od BMD: „BMD decyduje o wytrzymałości kości – wytrzymałość decyduje o złamaniach, a więc BMD decyduje o złamaniach”, odnosi się tylko do ograniczonego segmentu populacji, u których rzeczywiście taka zależność występuje. Czy to ma oznaczać, że tylko ten segment zasługuje na leczenie, a inny, który doznaje złamań niezależnych od BMD – nie?
Badanie „Rotterdam Osteoporosis Study” (6) pierwsze dostarczyło dowodów na niezależność bezwzględnej liczby złamań od BMD. Na 1000 kobiet w wieku 67-74 lat złamań b.n.k.u. przy T-score –0.5 odnotowano 3.2%, przy –1.0 – 10.8%, przy –1.5 – 28.9%, przy – 2.0 – 20.4%, a w zakresie „osteoporozy” przy –2.5 – 17.1%, poniżej –3.0 – 19.5%. Czyli 63.3% wszystkich złamań miało miejsce przy prawidłowej i obniżonej masie kostnej, a tylko 36.7% w „osteoporozie”. W polskim badaniu BOS (19), w losowo dobranej przez wojewódzką placówkę statystyczną, reprezentatywnej próbce populacji kobiet Podlasia powyżej 45 r.ż., w V dekadzie życia uczestniczyło 23.0%, w VI – 33.3%, w VII – 29.0%, w VIII – 13.7%, a w IX – 1.0% pań. 42.2% uczestniczek badania reprezentowało w BMD sz.k.u. normę, 42.0% - osteopenię i 14.8% - osteoporozę wg kryteriów WHO. Średnie T-score w sz.k.u. u wszystkich osób z przebytymi złamaniami po banalnym urazie wynosiło –1.6, a mierzone w L1-L4 – 1.5. Złamania miały miejsce w 25.7% u kobiet z prawidłową masą kostną, 50.0% w osteopenii i tylko w 24.3% w „osteoporozie”.
Równoczesna analiza rozkładu wieku w populacji polskiej wykazuje typowy kształt krzywej Gaussa z szczytem na wiek średni, zrozumiałym jest więc, że w najliczniej reprezentowanej wiekowo grupie osób i w największym odsetku osób o prawidłowej i obniżonej masie kostnej, odnotowuje się największą liczbę złamań. Wydarzeniem Sympozjum NOF w Honolulu 2002 roku, była meta-analiza rozkładu BMD, częstości i bezwzględnej liczby złamań. Jest ona podsumowaniem i konkluzją dotychczasowych wywodów: najliczniejsze są złamania przy prawidłowej i obniżonej masie kostnej (ale też jest to najliczniejsza część każdej populacji), natomiast częstość złamań rośnie w miarę obniżania się masy kostnej (a więc – z wiekiem, ale też z wiekiem maleje odsetek populacji).
![[Rozmiar: 49864 bajtów]](images/rozklad_resize.png)
Ryc 2. Rozkład BMD, częstość i liczba złamań osteoporotycznych.
Nie budzi już niczyjej wątpliwości, że oddziaływają na wytrzymałość kości również inne od BMD i niezależne od BMD czynniki ryzyka złamań. Poszczególne badania epidemiologii złamań przeprowadzone w różnych krajach różnią się mocą oddziaływania (RW) poszczególnych czynników, ale te tzw. silne, stale się powtarzają. Są nimi: wiek, przebyte w rodzinie złamanie b.n.k.u. po niewielkim urazie w rodzinie, przebyte uprzednio złamanie kości w podobnych okolicznościach, szybka przebudowa kości, niski wskaźnik masy ciała, a szczególnie waga poniżej 57 kg, w większości krajów nikotynizm, oraz niewydolność mięśniowo – nerwowa powodująca niezdarność ruchową sprzyjającą upadkom, a z wtórnych przyczyn – glikosteroidoterapia (2,6,9,14).
Dopiero połączenie i ocena wpływu obu tych składowych: klinicznych, pozaszkieletowych i BMD, umożliwia rozpoznanie indywidualnego ryzyka złamania i pomaga w określeniu progu interwencji leczniczej. Graficznie ilustruje to przekonywująco analiza Cummingsa i wsp. (9)
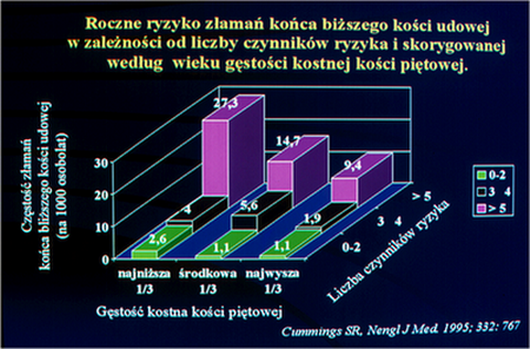
Ryc.3. Roczne ryzyko złamań końca bliższego kości udowej w zależności od liczby czynników ryzyka skorygowanej według wieku gęstości kostnej kości piętowej.
Decyzja czy i kogo leczyć, czyli ustalenie progu interwencji leczniczej, jest zadaniem trudnym. Pracują nad nim zespoły europejskie i amerykańskie. Ekonomika leczenia odgrywa, bo musi odgrywać, znaczące miejsce w decyzji. Uzasadnionym jest leczenie osoby, której ryzyko złamania jest większe od populacyjnego. 10-letnie prawdopodobieństwo jakiegokolwiek złamania osteoporotycznego wg Kanisa (13) – przy średnim ryzyku RW=1.0 u kobiety 50-letniej wynosi 5.8%, u 60-letniej – 9.6%, u 70-letniej – 16.1% i u 80-letniej – 21.5%. U mężczyzn odpowiednio 3.3%-4.7%-7.0%-12.6%.
Sposoby obliczania indywidualnego, bezwzględnego, 10-letniego ryzyka złamania opisano szczegółowo w poprzednim opracowaniu (2) i na stronie internetowej PFO: www.pfo.com.pl - Tutaj pragnąłbym zwrócić uwagę na „wskaźnik złamań” wg Blacka i wsp.(4) również opracowany na podstawie największego, prospektywnego badania amerykańskiego NHANES III (15). Bardzo trafnie ilustruje możliwość rozpoznania zagrożenia złamaniem z i bez badania BMD. Posługuje się pytaniami i skalą punktową odpowiedzi.
- Wiek: poniżej 65 r.ż. – 0 punktów (pkt), 65-69 lat – 1 pkt, 70-74 – 2 pkty, 75-79 – 3 pkty, 80-84 – 4 pkty, 85 i powyżej – 5 pktów.
- Przebyte złamania kości po 50 r.ż.: tak – 1 pkt, nie – 0 pkt.
- Złamanie b.n.k.u. u matki po 50 r.ż.: tak – 1 pkt, nie – 0 pkt.
- Waga poniżej 57 kg: tak – 1 pkt, nie – 0 pkt.
- Nikotynizm aktualny: tak – 1 pkt, nie – 0 pkt.
- Możliwość wstania z fotela bez pomocy rąk: tak – 0 pkt, nie – 2 pkty
- Aktualne BMD-Total Hip T-score: większe od –1.0 – 0 pktów, pomiędzy –1.0 i –2.0 – 2 pkty, pomiędzy 2.0 i 2.5 – 3 pkty, mniejsze od –2.5 – 4 pkty.
Suma punktów wyznacza „wskaźnik złamania” odpowiadający 5-letniemu, bezwzględnemu ryzyku złamań kręgów i pozakręgowych bez badania BMD ( 1 pkt – 10.5%, 3 pkty – 16.4%, 5-9 pktów – 26.1%), i z BMD (1-2 pkty – 8.6%, 5 pktów – 16.5%, 8-13 pktów – 27.5%). Bez badania BMD wyraźny wzrost ryzyka uwidacznia się od 5 pktów, a z badaniem densytometrycznym – od 8 pktów. „Wskaźnik złamań” nie wyznacza progu interwencji leczniczej, ale uzmysławia rosnące zagrożenie złamaniem w miarę wzrostu czynników ryzyka i/lub spadku BMD.
Relacja pomiędzy BMD a odpowiedzią na leczenie p/resorpcyjne.
Jest to tyle ważne, co ciekawe zjawisko, to, jak i vice versa: zachowanie się BMD w czasie leczenia p/resorpcyjnego. Niżej cytowane (5,7,10,11,20) próby kliniczne dostarczyły przekonywującego materiału aby poczynić następujące uogólnienia:
- Leczenie lekami hamującymi resorpcję kości wykazuje swoją skuteczność przy masie kostnej mniejszej od T-score –2.0, nieuzasadnionym jest więc wszczynanie tego leczenia nawet przy bardzo wysokim ryzyku złamania (ocenionym na podstawie klinicznych czynników ryzyka) bez uprzedniego pomiaru BMD.
- Wielkość wzrostu masy kostnej jest niewspółmierna do skali zahamowania nowych złamań, 1-2% wzrostowi BMD może towarzyszyć 30-40% zahamowania nowych złamań.
- Brak wzrostu BMD nie oznacza nieskuteczności leczenia i potrzeby zmiany leku, zaś obniżenie BMD w trakcie leczenia może być wskazówką do zmiany leczenia. Informatywność śledzenia i ocena skuteczności leczenia przy pomocy BMD mają więc swoje ograniczenia.
Odpowiedzią na pytanie: co leczymy?- jest: zagrożenie złamaniem, z czegokolwiek by nie wynikało. Odpowiedzią na pytanie: kogo leczymy? – jest: osobę obciążoną ryzykiem złamania powyżej ryzyka populacyjnego, a ryzyko to wynika z klinicznych, pozaszkieletowych i szkieletowych przyczyn, które łącznie oceniane wyznaczają próg interwencji leczniczej.
Indywidualne dopasowanie leczenia do problemu zdrowotnego pacjenta jest wymogiem niezbywalnym. Lek uniwersalny na osteoporozę, z „wyboru”, istnieje tylko w niewybrednych materiałach marketingowych. Aby zaś dopasować leczenie „na miarę pacjenta”, niezbędne są informacje o jego pozaszkieletowych chorobach i czynnikach obniżających jakość funkcjonalną kości. Niektóre leki, oprócz właściwości hamowania resorpcji kości, wykazują również korzystne i pożądane oddziaływanie na inne tkanki. Czy wolno nam ich nie wykorzystać do potrzeb indywidualnego pacjenta? – Kolejną odpowiedzią na pytanie: jak leczymy? – jest znów: indywidualnie, na miarę problemu zdrowotnego pacjenta.
Czym leczymy?
- Dotyczącym nas wszystkich, całej populacji kobiet i mężczyzn, zdrowych i chorych, obowiązkiem jest wyeliminowanie (jeśli jest to możliwe) lub zminimalizowanie oddziaływania znanych czynników ryzyka złamań i osteoporozy, oraz tych, które zwiększają wydalanie wapnia. Wobec powszechnych niedoborów witaminy D, suplementację w dawce 400 – 800 mg zaleca się wszystkim, a spożycie wapnia elementarnego – w produktach spożywczych i preparatach doustnych w 3-6 dekadzie życia – 1000 mg, a od końca 6 dekady – 1200-1500 mg. Dawka 1000 mg dziennie (najlepiej wchłaniana w dawkach podzielonych razem z głównymi posiłkami) przy normowitaminozie D zabezpieczają przed pobudzaniem przytarczyc.
- Zachowana aktywność fizyczna obciążająca kości jest nie tylko najsilniejszym ze znanych stymulatorów osteogenezy, ale zapewnia sprawność ruchową zapobiegającą upadkom, najważniejszej przyczynie złamań.
- Uzasadnione oceną ponadpopulacyjnego ryzyka złamania leczenie antyresorpcyjne wybiera się kierując się wieloma determinantami: bezpieczeństwem, skutecznością w hamowaniu nowych złamań, korzyściami w oddziaływaniu leczniczym na inne tkanki i narządy, tolerancją i akceptacją leku i jego ceny przez pacjenta, przewidywaną dyscypliną i możliwościami przyjmowania i kontynuowania leczenia przez pacjenta. Ustalenie priorytetów: co należy osiągnąć w pierwszej kolejności, a co później, co byłoby najwłaściwszym wyborem dla danego pacjenta, a co wyborem z konieczności (cena, nietolerancja, obawa, zła reputacja leku w otoczeniu pacjenta).
Najczęstszymi przyczynami przerwania leczenia jest utrata motywacji: przestało boleć – po co kontynuować drogie leczenie?, lub: biorę już długo tak drogie leczenie – a jak bolało, tak boli... O ile w pierwszym przypadku cena, uciążliwość leczenia, czy niezbyt przekonywująca argumentacja lekarza leczącego mogą składać się na niepowodzenie, o tyle w drugim – błąd tkwi w nie zdiagnozowaniu przyczyn bólu, z powodu którego pacjent zgłosił się do lekarza o pomoc. Dotyczy to najczęściej bólów pleców i krzyża, a czasami i kończyn. Wykonana diagnostyczna densytometria nawet jeśli wykazała „osteoporozę”, a w ślad za nią leczenie antyresorpcyjne, nie usunęła bólowego problemu pacjenta, bo nie „osteoporoza” była jego przyczyną.
A skuteczność leku?
Warunkiem rejestracji i rekomendacji leku antyresorpcyjnego do leczenia osteoporozy jest wykazanie skuteczności w hamowaniu nowych złamań w wieloośrodkowej, podwójnie ślepej, z losowo dobranymi pacjentami, pod kontrola placebo, próbie. Taki egzamin zdały: działające drogą receptorową - wapń, witamina D, estrogeny, raloksyfen, kalcytonina ( wkrótce parathormon i renelat strontu) oraz działające drogą niereceptorową bisfosfoniany – risedronian, alendronian i etydronian. Ich aktywność w hamowaniu nowych złamań sięga 30-50-% po trzech latach, niektóre już w pierwszy roku wykazują ponad 60% skuteczność i utrzymują ją w czwarty i piątym roku badania. Czy cyfra skuteczności antyzłamaniowej leku oddaje skuteczność leczenia i czy upoważnia do porównań? – zdecydowanie nie! – Nie wykonano jeszcze ani jednej próby z przynajmniej dwoma lekami antyresorpcyjnymi nastawionymi nie na ocenę BMD ale złamań w tej samej populacji. Dowód skuteczności dotyczy więc wyłącznie populacji o określonym zagrożeniu złamaniami, o określonym stadium zaawansowania choroby, o określonej jakości funkcjonalnej i masie kostnej. Właściwym kryterium oceny populacji, u której przeprowadzono próbę kliniczną, są losy grup referencyjnych, leczonych (placebo) we wszystkich próbach porównywalnie wapniem i witaminą D. Liczba osób za złamaniami po trzech latach oddaje obraz zaawansowania osteoporozy osób biorących udział w testowaniu leku.
![[Rozmiar: 93141 bajtów]](images/losy.png)
Ryc 4. Losy (złamania) grup placebo w 5 próbach klinicznych FIT (5), MORE (10), VERT NA (14), PROOF (7), VERT (20).
Rada Naukowa Polskiej Fundacji Osteoporozy, kierując się logiką przedstawionych tu argumentów zajęła adekwatne do nich stanowisko, poddając je powszechnej dyskusji.
STANOWISKO RADY NAUKOWEJ POLSKIEJ FUNDACJI OSTEOPOROZY WOBEC DIAGNOSTYKI I LECZENIA OSTEOPOROZY, Czerwiec 2002
Prof. J. Badurski, Doc. E. Czerwiński, Prof. J. Gmiński, Prof. W. Horst-Sikorska, Prof. E. Marcinowska –Suchowierska, Prof. A. Milewicz, Doc. T. Opala i Prof. W. Tłustochowicz.
Definicje osteoporozy (OP):
1./ I. Wg WHO (1994)/ IOF(2000):
„OP jest chorobą układową szkieletu charakteryzującą się zmniejszoną masą kości ,zmienioną mikroarchitekturą, oraz zwiększoną podatnością na złamania”Odpowiednikami densytometrycznymi masy kostnej są:
- Prawidłowa: +1.0 do –1.0 odchylenia standardowego (T- score) od szczytowej masy kostnej młodych, zdrowych kobiet;
- Osteopenia: -1.0 do –2.5 j.w.;
- Osteoporoza:- poniżej –2.5;
- Osteoporoza zaawansowana: poniżej – 2.5 z obecnością złamań;
Powyższe normy wynikają z pomiarów gęstości kości (BMD) w szyjce kości udowej (sz.k.u.);
Wzorcem (przyjętym przez IOF i NOF na podstawie badania NHANES-3) progowego dla diagnostyki OP T-score jest BMD sz.k.u. = 0.572 g/cm2; (aparatem DXA f-my HOLOGIC), z późniejszym zastrzeżeniem, że: „Próg densytometryczny rozpoznania osteoporozy jest inny niż próg zagrożenia złamaniami i interwencji leczniczej”
1./II. Wg NIH/NOF (2000):
„OP jest chorobą szkieletu cechującego się zmniejszoną wytrzymałością kości i zwiększającą ryzyko złamania”.
- Celem pierwszoplanowym diagnostyki nie jest wypełnienie densytometrycznych kryteriów osteoporozy, ale ocena ryzyka złamania, leczenia zaś – zapobieganie złamaniom.
- Bezwzględna liczba złamań jest największa zanim jeszcze utrata masy kostnej przekroczy densytometryczny próg osteoporozy, częstość ich zaś wzrasta z wiekiem i w miarę spadku BMD.
- Ocenę zagrożenia złamaniem opiera się o identyfikację obecności i mocy oddziaływania (oznaczanego wartościami „ryzyka względnego – RW”) szkieletowych (BMD, tempo przebudowy kości) i poza szkieletowych , klinicznych (wiek powyżej 65 r.ż., przebyte złamania po 50 r.ż. w wyniku niewielkiego urazu, złamania biodra u matki, waga ciała poniżej 58 kg, znaczne inwalidztwo ruchowe ze skłonnością do częstych upadków, szybka przebudowa kości) czynników ryzyka osteoporozy i złamań. Ryzyko złamania rośnie w miarę wzrostu liczby w/w klinicznych czynników ryzyka i w miarę obniżania się masy kostnej.
- Miarą oceny jest indywidualne, absolutne, 10 – letnie zagrożenie złamaniem i ono wyznacza próg interwencji leczniczej.
- Analiza badań epidemiologicznych wyróżnia czynniki zwiększające wydalanie wapnia, zwiększające utratę masy kostnej (zwiększające ryzyko osteoporozy) oraz zwiększające ryzyko złamań.
- Przedmiotem szczególnego zainteresowania, tzn. diagnostyki, zapobiegania i/lub leczenia, są osoby obarczone w/w cechami.
- „Zapobieganie osteoporozie” oznacza wpływ na wzrost gęstości kości.
- Całej populacji zaleca się aktywny, obciążający szkielet tryb życia, dietę pokrywającą zapotrzebowanie na ok. 1000 mg wapnia i 400-800 mg witaminy D oraz potas, białko roślinne oraz pokarmy nie zakwaszające.
- Leczenie obejmuje eliminację lub zmniejszenie mocy oddziaływania czynników ryzyka, wzmożenie aktywności fizycznej obciążającej szkielet, oraz leczenie lekami hamującymi resorpcję i/lub stymulującymi budowę kości.
- Leczenie lekami antyresorpcyjnymi jest skuteczne wyłącznie przy niskiej
- masie kostnej, poniżej T-score –2.0, przed jego rozpoczęciem istnieje więc wymóg sprawdzenia gęstości kości metodą DEXA w szyjce kości udowej i w kręgosłupie.
- Leczenie antyresorpcyjne obejmuje leki, które udowodniły skuteczność hamowania złamań:
- Wapń z witaminą D, estrogeny i HRT (do 60 r.ż.), z grupy SERM – raloksyfen (tabl. 60 mg/dz.), kalcytoninę w postaci donosowej (200 IU/dz.) – i znajdującej
- zastosowanie kliniczne - iniekcyjnej (100 IU) oraz bisfosfoniany: risedronian (5 mg/dz.), alendronian (10 mg/dz. - i proponowane do stosowania – 1 x 70 mg/tyg.) oraz etydronian (400 mg/dz. przez 14 dni 4 razy w roku, co 3 miesiące, nie dłużej niż dwa lata).
- Obowiązuje wymóg indywidualnego dostosowania leku do pacjenta,
- uwzględniając zarówno historię choroby pacjenta, jak i poza szkieletowe, lecznicze oddziaływania poszczególnych antyresorbantów, które powinny być wykorzystane również w leczeniu innych zagrożeń zdrowotnych chorego, poza osteoporozą.
- Monitorowanie BMD nie częściej niż co 12 miesięcy, przy czym brak wzrostu BMD nie oznacza braku odpowiedzi na leczenie i nieskuteczności leku, spadek BMD w trakcie leczenia może wskazywać na potrzebę jego zmiany.
- Wobec intensywnych prac w Europie i w USA nad znalezieniem racjonalnych progów interwencji leczniczej przy ustalonym j.w. indywidualnym, bezwzględnym 5 lub 10-letnim ryzyku, w chwili ich opublikowaniu będą uwzględnione w następnej edycji Stanowiska R.N. PFO. Również po rejestracji w Polsce parathormonu i preparatu strontu do leczenia osteoporozy, zostaną one uwzględnione w Stanowisku.
PIŚMIENNICTWO
- Albright F, Smith PH, Richel AM (1941) Postmenopausal osteoporosis: its clinical features. JAMA 116:2465-2474.
- Badurski JE (2001) Zasady diagnostyki osteoporozy i ryzyka złamań oraz leczenia farmakologicznego. Post Osteoartrol 12: Supl 146-179.
- Black DM (On behalf of ISCD/NOF/ASBMR Working Group) (2000) Revision of T-score BMD diagnostic thresholds. Osteoporos Int 11: Supl.2/ S58.
- Black DM (2001) Fracture Risk Assessment Tool. Osteoporos Int 12:519-528.
- Black DM, Cummings SR, Karpf DB (1996) Randomized trial of effect of alendronate on risk of fracture in women with existing vertebral fractures. Fracture Intervention Trial Research Group. Lancet 348: 1535-41.
- Burger H, de Laet CE, van Daele PL, Weel AE, Witteman JC, Hofman A, Pols HA (1998) Risk factors for increased bone loss in an elderly population: the Rotterdam Osteoporosis Study. Am J Epidemiol May 1;147 (9): 871-879.
- Chesnut Ch H, Silverman S, Adriano K, Genant H, Gimona A, Harris S, Kiel D et al. (2000) A randomized trial of nasal spray calcitonin in postmenopausal women with established osteoporosis: the Prevent Recurrence of Osteopotic Fractures Study. Am J. Med. 109:267-273
- Chesnut Ch H, (2001) Zapobieganie nawrotom złamań osteoporotycznych (Badanie PROOF). Post Osteoartrol 12: 108-126
- Cummings SR (1995) Risk factors for hip fracture in white women. N Engl J Med 332:767-773.
- Ettinger B, Black DM, Mitlak BH, (1999) Reduction of vertebral fracture risk in postmenopausal women with osteoporosis treated with raloxifene: results from a 3-year randomized clinical trial. Multiple Outcomes of Raloxifene Evaluation (MORE) Investigators. JAMA 282:637-645.
- Harris ST, Watts NB, Genant HK, ( 1999) Effect of risedronate treatment on vertebral and nonvertebral fractures in women with postmenopausal osteoporosis: a randomized controlled trial. Vertebral Efficacy with Risedronate Therapy (VERT) Study Group. JAMA 282:1344-52.
- Kanis JA, Gluer CC (2000) An update on the diagnosis and assessment of osteoporosis with densitometry. Osteoporos Int 11/3:192-202.
- Kanis JA, Johnel O, Oden A, Dawson A, De Laet C, Jonsson B. (2001) Ten Year Probabilities of Osteoporotic Fractures According to BMD and Diagnostic Thresholds. Osteoporos Int. 12:989-995.
- Kanis JA (2001) Diagnostic criteria for osteoporosis – where do we stand? Osteoporos Int 12: Supl 1, S1.
- Looker AC, Orwoll ES, Johnson CC, Lindsay R, Wahner HW, Dunn WL Calvo MS et co (1997) Prevalence of low femoral bone density in older US adults from NHANES 3. J Bone Miner Res 12:1761-1768.
- Marshall D, Johnell O, Weder H (1996) Meta-analysis of how well measures of bone mineral density predict occurrence of osteoporotic fractures. Br Med J 312:1254-1261.
- McGrother CW, Donaldson MMK, Clayton D, Abrams KR, Clarke M (2002) Evaluation of a Hip Fracture Risk Score for Assessing Elderly Women: The Melton Osteoporotic Fracture (MOF) Study. UZUPEŁNIĆ
- NIH Consensus Conference on Osteoporosis Prevention, Diagnosis, and Therapy (2001) JAMA 285/6: S 785
- Nowak NA, Badurski JE, Supronik J, Dobreńko A, Daniluk S, Rybaczuk M (2001) Bialystok Osteoporosis Study (BOS): Epidemiology of low trauma fractures in the female population. Osteoporos Int 12:Supl.1: L03.
- Reginster J, Minne HW, Sorensen OH et al. (2000). Randomized trial of the effects of risedronate on vertebral fractures in women with established postmenopausal osteoporosis. Vertebral Efficacy with Risedronate Therapy (VERT) Study Group. Osteoporos Int. 11:83-91.
- WHO Study Group. (1994) Assessment of fracture risk and its application to screening for postmenopausal osteoporosis. Geneva: Technical report 843. World Health Organization.
| Powrót na górę strony © Copyright Polska Fundacja Osteoporozy |